| Меню сайту |
|
 |
| Форма входу |
|
 |
| Календар |
| « Жовтень 2025 » | | Пн | Вт | Ср | Чт | Пт | Сб | Нд | | | | 1 | 2 | 3 | 4 | 5 | | 6 | 7 | 8 | 9 | 10 | 11 | 12 | | 13 | 14 | 15 | 16 | 17 | 18 | 19 | | 20 | 21 | 22 | 23 | 24 | 25 | 26 | | 27 | 28 | 29 | 30 | 31 |
|
 |
|
УРОК 18
Тема. Фізичні й хімічні властивості кислот
Цілі уроку: ознайомити учнів з фізичними й хімічними властивостями кислот.
Тип уроку: вивчення нового матеріалу.
Форми роботи: розповідь учителя, демонстраційний експеримент, лабораторні досліди, робота з опорною схемою.
ХІД УРОКУ
І. Організація класу
ІІ. Перевірка домашнього завдання актуалізація опорних знань
На попередніх уроках ми познайомилися з фізичними й хімічними властивостями оксидів.
1.Гра «Мозковий штурм»:
1) Які класи неорганічних сполук ми з вами вивчили?
2) Що таке оксиди?
3) На які групи поділяють всі оксиди?
4) Що таке основні оксиди?Приклади.
5) Що таке кислотні оксиди?Приклади.
6) Амфотерні оксиди … Приклади.
7) В якій реакції вступають основні оксиди?
8) З чим реагують кислотні оксиди?
9) З чим реагують амфотерні оксиди?
10) З якими класами неорганічних речовин узаємодіють оксиди? (З водою, з лугами — кислотні оксиди, з кислотами — основні оксиди, з іншими оксидами)
2.Розставте знак «плюс» там, реакція можлива, виходячи з властивостей оксидів.
|
Основний оксид
|
Кислота
|
Основа
|
Сіль
|
Кислотний оксид
|
+
|
|
+
|
|
Кислота
|
+
|
|
|
|
Основа
|
|
|
|
|
Сіль
|
|
|
|
|
— А як же інші клітинки? Щоб заповнити їх, ми повинні вивчити хімічні властивості інших класів неорганічних сполук.
ІІІ. Вивчення нового матеріалу
Фізичні й хімічні властивості кислот
Коли ми вивчали класифікацію кислот, звернули увагу, що більшість відомих кислот — це водні розчини. Без води їх властивості змінюються.
Вивчення хімічних властивостей кислот ми проведемо за планом:
• Дія кислот на індикатори
• Взаємодія кислот з металами
• Взаємодія кислот з оксидами
• Взаємодія кислот з основами
• Взаємодія кислот із солями
Акуратно капаємо в перший ряд по дві краплі хлоридної кислоти, у другий ряд — по дві краплі сульфатної кислоти. Далі в перше заглиблення з кислотами додаємо одну краплю метилового оранжевого, у друге — одну краплю лакмусу, у третє — одну краплю фенолфталеїну.
На підставі спостережень заповнюємо таблицю.
|
Метиловий оранжевий
|
Лакмус
|
Фенолфталеїн
|
Нейтральний
|
Оранжевий
|
Фіолетовий
|
Безбарвний
|
HCl
|
Червоний
|
Рожевий
|
Безбарвний
|
Н2S04
|
Червоний
|
Рожевий
|
Безбарвний
|
Висновок. У розчинах кислот метиловий оранжевий набуває червоного забарвлення, лакмус — рожевого. Отже, розчини кислот молена визначити з допомогою індикатора метилоранжу або лакмусу.
Розглянемо, як взаємодіють кислоти з металами Mg,Zn,Cu .
Для експерименту в три пробірки наливаємо хлоридну кислоту; у першу додаємо шматочки мідного дроту, у другу — гранули цинку, у третю — магнієву стружку.
Це пов’язано з властивостями металів. М. М. Бекетов розташував метали відповідно до їх активності в ряд від найсильніших до найслабших, Цей ряд так і називається — ряд активності металів. (Розглядаємо таблицю, знаходимо ряд активності металів у підручнику.) Водень серед металів перебуває не випадково. Він розділяє метали на активні, які витісняють водень із розчинів кислот, і ті, що не взаємодіють із розчинами кислот і водень не витісняють»

Запишемо рівняння реакцій:
Си + НСl = - не реагує.
Zn + 2НСl —> ZnСl2 + Н2↑
Мg + 2НСІ -> МgСl2. + Н2 ↑
Укажіть тип реакції.(Реакція заміщення)
Увага! Нітратна кислота по-особливому реагує з металами. Водень не витісняється жодним із металів, наприклад:
Zп + 4НNO3 —>Zn(N03 )2 + 2Н2О + 2N02
3) Із попередніх уроків ми знаємо, що кислоти можуть реагувати тільки з якими оксидами? (З основними)
Насиплемо в пробірку кальцій оксид, додамо розчин хлоридної кислоти. Що спостерігаємо? {Оксид розчинився)
Запишемо рівняння реакції:
СаО + 2НCl -> СаСl2 + Н20
Укажіть тип реакції.(Реакція обміну)
4) У пробірку наливаємо натрій гідроксид, додаємо кілька крапель фенолфталеїну — розчин забарвлюється в малиновий колір. Потім по краплях додаємо хлоридну кислоту. Яку ознаку реакції спостерігаємо? (Знебарвлення розчину) Запишемо рівняння хімічної реакції:
— Чому знебарвлюється розчин? (Середовище стало нейтральним) Укажіть тип реакції. (Реакція обміну)
Така реакція між розчинами кислот і основ називається реакцією нейтралізації. Поясніть, чому.
Висновок. Кислоти взаємодіють із солями.
б) Кислоти можуть витісняти більш слабкі кислоти з їхніх солей.
З’являються бульбашки газу — ознака протікання хімічної реакції. Запишемо рівняння:
Н2С03 ->Н20 + С02↑
IV. Закріплення вивченого матеріалу.
Підіб’ємо підсумки сьогоднішнього уроку.
Візьміть таблицю* яку ми почали заповнювати на початку уроку.
-
В які ще клітинки ми можемо поставити знак «плюс»?
-
VI. Домашнє завдання
Опрацювати відповідний параграф підручника, відповісти на запитання до нього, виконати вправи.
УРОК 19
Тема. Хімічні властивості кислот» Реакції заміщення й обміну. Заходи безпеки під час роботи з кислотами. Використання кислот
Цілі уроку: закріпити знання про хімічні властивості кислот на прикладі хлоридної кислоти; поглибити знання учнів про реакції заміщення й обміну на прикладі хімічних властивостей кислот; розвивати навички експериментальної роботи з кислотами; повторити правила техніки безпеки під час роботи з кислотами; ознайомити учнів з галузями використання кислот.
Тип уроку: формування вмінь і навичок, урок-дослідження.
Форми роботи: розповідь учителя, лабораторні досліди, робота з опорною схемою, робота з підручником.
ХІД УРОКУ
1. Організація класу
II. Перевірка домашнього завдання, актуалізація опорних знань
Завдання 1
Учень розповідав біля дошки про хімічні властивості кислот. Знайдіть помилки в нижченаведених висловлюваннях і виберіть тільки ті хімічні властивості, які характерні для кислот:
а) забарвлення розчину лакмусу в синій колір;
б) забарвлення розчину лакмусу в червоний колір;
в) взаємодія з металами;
г) взаємодія з кислотними оксидами;
д) взаємодія з основними оксидами;
е) взаємодія з основами;
ж) взаємодія з кислотами.
Наведіть рівняння відповідних реакцій і назви продуктів реакцій у вигляді опорної схеми «Властивості кислот».
Завдання 2
Робота з опорною схемою «Хімічні властивості кислот».
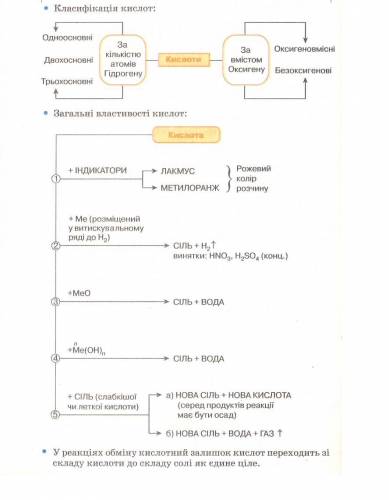
III. Формування навичок і вмінь
Лабораторна робота № 2. Взаємодія хлоридної кислоти-з металами
На кожному столі — дев'ять пробірок з номерами та склянка з хлоридною кислотою,
Учитель нагадує учням про необхідність дотримання правил техніки безпеки під час виконання лабораторної роботи. Особливу увагу слід приділити заходам безпеки під час роботи з кислотами. (Розглядаємо підготовлені учнями схеми.)
— Назвіть правила першої допомоги в разі потрапляння кислоти на шкіру або в очі. {Рясно промити водою; шкіру промити розчином харчової соди, що є в лабораторній аптечці)
Завдання. У протоколі під номером пробірки зазначений реактив, що міститься в цій пробірці. Акуратно додаєте в кожну пробірку три-чотири краплі хлоридної кислоти, записуєте ознаки реакції та висновок про властивість хлоридної кислоти.
Протокол лабораторної роботи № 1 Взаємодія хлоридної кислоти з різними речовинами
№
пробірки
|
Назва реагенту
|
Ознаки
реакції
|
Рівняння
реакції
|
Висновки
|
1
|
|
|
|
|
2
|
Mg — магній
|
|
|
|
3
|
Сu — мідний дріт
|
|
|
|
4
|
Al - алюміній гранульований
|
|
|
|
5
|
СuО — купрум(ІІ) оксид
|
|
|
|
6
|
NаОН — натрій гідроксид
|
|
|
|
7
|
Fe2O3 — ферум (III) оксид
|
|
|
|
8
|
Nа2С03 — натрій карбонат
|
|
|
|
9
|
CaC03 — Кальцій карбонат
|
|
|
|
|
IV Закріплення вивченого матеріалу Підбиття підсумків лабораторної роботи
Кожна група учнів по черзі зачитує результати експерименту, учні спільно вносять виправлення в протоколи, роблять висновки.
Візьміть таблицю «Взаємозв'язок між класами неорганічних сполук».
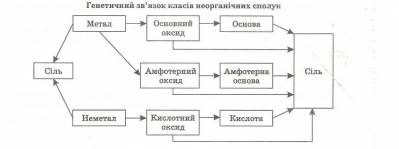
— В які ще клітинки ми можемо поставити знак «плюс»?
Взаємозв’язок між класами неорганічних сполук
|
Основний оксид
|
Кислота
|
Основа
|
Сіль
|
Кислотний оксид
|
+
|
|
+
|
|
Кислота
|
+
|
|
+
|
+
|
Основа
|
|
+
|
|
|
Сіль
|
|
+
|
|
|
|
Продовжимо заповнювати таблицю на наступному уроці.
Опрацювати відповідний параграф підручника, відповісти на запитання до нього, виконати вправи.
Творче завдання. Скласти за підручником схему «Використання кислот
Тема.Реакція нейтралізації. Розкладання нерозчинних основ у процесі нагрівання
Цілі уроку:закріпити знання учнів про хімічні властивості основ; розвивати вміння й навички проведення хімічного експерименту, складання рівнянь хімічних реакцій на прикладі хімічних властивостей лугів і нерозчинних основ,
Тип уроку: формування вмінь і навичок, урок дослідження.
Форми роботи:формування вмінь і навичок, урок-дослідження. лабораторна робота, робота з опорною схемою.
ХІД УРОКУ
II. Перевірка домашнього завдання, актуалізація опорних знань
1. ВаО+ Н20 —> Ва (ОН)2
2. С02+Н20 -> Н2С03
3. 4. Ва(ОН)2 +Н2С03 -> ВаС03 + 2Н20
Робота з опорною схемою «Хімічні властивості основ»
• На основі знань про хімічні властивості основ заповнимо опорну схему «Хімічні властивості основ».
• Згадаймо, яких правил необхідно дотримуватися в хімічній лабораторії. {Звертаємося до таблиці «Правила техніки безпеки в кабінеті хімії»,)
Лабораторна робота № 4. Взаємодія розчинів лугів з кислотами
У дві пробірки наливаємо по 1 мл NаОН і по одній-дві краплі фенолфталеїну. Потім в одну з них по краплях додаємо хлоридну кислоту, у другу — сульфатну кислоту. Заносимо результати до протоколу.
Реагенти
|
Що спостерігаєте?
|
Рівняння реакції
|
Висновок
|
NаОН
|
|
|
|
|
NaОН
|
Н2S04
|
|
|
|
|
|
HCl
|
|
|
|
Лабораторна робота № 5 Взаємодія нерозчинних основ з кислотами .Нам необхідно одержати купрум(ІЇ) гідроксид. Як це зробити? Яку властивість основ для цього можна використати?
Сu S04 + 2NаОН -> Сu(ОН)2 + Nа2 S04 До одержаного осаду по краплях додаємо хлоридну кислоту.
— Які ознаки хімічної реакції спостерігаємо?
Запишіть результати досліду до протоколу.
Лабораторна робота № 6. Розкладання нерозчинних основ у процесі нагрівання
Нерозчинні основи за нагрівання розкладаються на оксид і воду. Перевіримо це на практиці.
Одержіть купрум(ІІ) гідроксид, закріпіть пробірку в пробіркотримачі.
• Як правильно нагріти пробірку?
• В якій частині полум'я необхідно нагрівати пробірку? (У верхній, найбільш гарячій)
• Що спостерігаємо? Запишемо рівняння реакції:
Сu(ОН)2 —> Сu0 +Н20 Укажіть тип реакції. (Реакція розкладу)
Висновок. З якими властивостями основ ми познайомилися на цьому уроці?
• Реакція нейтралізації.
• Розклад нерозчинних основ.
IV. Закріплення вивченого матеріалу Керована практика
Завдання 1. Обчисліть кількість речовини води, що утвориться внаслідок нагрівання алюміній гідроксиду масою 15,6 г.
|
|
|
|
Дано:
m (АL(0Н)3) = 15,6 г
|
|
|
|
|
|
15,6 г, 0,2 моль Х моль
2АL(0Н)3 -> АL203 +Н20
2 моль 3 моль
1) Обчислимо кількість речовини АІ(ОН)„ за формулою
ν =m/M
ν (AL(ОН)3 ) =15,6 г/78 г/моль = 0,2 моль.
2) Складемо пропорцію й обчислимо кількість речовини води:
0,2 моль : 2 моль = х моль : 3 моль
ν (Н20) = 0.2*3 / 2 = 0,3 (моль).
Відповідь: 0,3 моль.
Завдання 2. Здійсніть перетворення:
Сu(ОН)2 -> СuО -> СuS04 -> Сu(ОН)2
1) Сu(ОН)2 -> Сu0 + Н20
2) Сu0+Н2 S04 -> СuS04 + Н20
3) СuS04 +2NаОН -> Сu(ОН)2 +Na2S04
VI. Домашнє завдання
Опрацювати параграф 15 підручника, виконати завдання №1,2,3,4 до нього. Творче завдання. Підготувати повідомлення про використання основ.
VII. Оцінювання знань.
|
| Міні-чат |
|
|
 |
| Статистика |
Онлайн всього: 1 Гостей: 1 Користувачів: 0 |
 |
|

 Virtual chemistry laboratory
Virtual chemistry laboratory 














