За матеріалами підручника "Хімія" 8кл. за ред. Ярошенко О.Г.
Що учневі обов"язково треба знати!
Для характеристики речовин використовують різні фізичні величини. Однією з них є кількість речовини (v). Фізичну величину кількість речовини введено для позначення числа структурних частинок речовини у певній її порції. Кількість речовини вимірюється в молях.
Моль — це кількість речовини, що містить число Авогадро структурних частинок (атомів, молекул чи інших формульних одиниць) цієї речовини. 1 моль будь-якої речовини містить число Авогадро структурних частинок речовини. Число Авогадро позначається NА і дорівнює 602 000 000 000 000 000 000 000.
Молярна маса М — це маса одного моля речовини, чисельно вона дорівнює її відносній молекулярній масі.
Молярну масу речовини можна обчислити, поділивши масу порції речовини т на кількість речовини v в ній: М =m/v
1 моль будь-якої речовини містить однакове число — 6,02 • 1023 — формульних одиниць речовини (атомів, молекул тощо). Це — число Авогадро.
Похідними формулами від формули для обчислення молярної маси речовини є: v =m /М та m = у*М.
Газуваті речовини, як і рідини, не мають власної форми, а набувають форми посудини, в яку їх помістили. За різних температури і тиску 1 моль газуватої речовини займає різний об'єм. За температури О*С і тиску 101,3 кПа порція будь-якої газуватої речовини кількістю речовини 1 моль займає об'єм 22,4 л (округлено). Ці умови дістали назву нормальних умов (н.у.), а об'єм — молярного об'єму Ут. Для обчислення об'єму порції газуватої речовини потрібно кількість речовини в цій порції помножити на молярний об'єм: V=v*Vm
Відносна густина газів — це безрозмірна величина, що показує, у скільки разів один газ важчий або легший за інший. Для обчислення відносної густини газу відносну молекулярну чи молярну масу одного газу ділять на відносну молекулярну чи молярну масу іншого газу. Вибір способу збирання газів витісненням повітря здійснюють на основі результатів обчислення відносної густини газів за повітрям: якщо вона більша за одиницю, то посудину для наповнення газом тримають донизу дном, а якщо менша — догори дном.
Хімічна формула речовини відображає її якісний та кількісний склад і дає змогу здійснювати обчислення кількості речовини, відносної молекулярної маси, молярної маси, об'єму та маси порції речовини, числа структурних частинок речовини у певній її порції. • За хімічною формулою обчислюють також масові частки елементів та відношення мас елементів у речовині.
Використовуючи число Авогадро, здійснюють обчислення числа структурних частинок речовини у певній її порції, встановлюють молекулярну формулу речовини.
Обчислення із застосуванням числа Авогадро проводять за формулами: v = N/NA;
М = m*NA/N;V =VM*N/NA
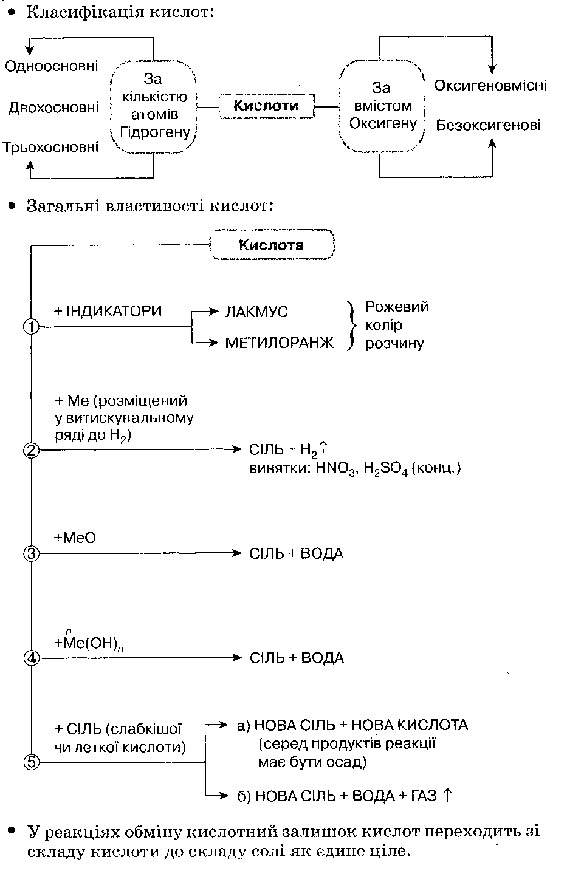
Кислоти — окремий клас неорганічних сполук, молекули яких складаються з атомів Гідрогену, здатних заміщуватися атомами металів, та кислотного залишку.
Валентність кислотного залишку визначається кількістю атомів Гідрогену, які можуть бути заміщені на атоми металу.
Користуючись кислотами, необхідно пам'ятати про їх хімічні властивості й суворо дотримуватися правил безпечної роботи з ними.
Витискувальний ряд металів, або ряд активності металів — це ряд, в якому метали розташовані за їх здатністю витискувати Гідроген із кислот. Метали, розташовані в ряді активності до водню, витискують Гідроген з кислот, метали, розташовані в ряді активності після водню,— не витискують. Якісною реакцією на водень є його взаємодія з киснем, під час якої чується приглушене хлопання — вибух. Щоб ця реакція відбулася, достатньо запалений сірник піднести до отвору пробірки з воднем. Кислоту в розчині можна виявити за допомогою індикаторів лакмусу та метилового оранжевого.
До класу солей належать складні речовини, утворені атомами металів і кислотними залишками. У формулах солей сума одиниць валентності металу дорівнює сумі одиниць валентності кислотного залишку. Складаючи формулу солі, необхідно знати валентність металу та кислотного залишку. За сучасною номенклатурою, назви солей утворюють з назви металу і назви кислотного залишку та зазначають валентність тих металів, у яких вона має кілька значень.
Основи — складні речовини немолекулярної будови, хімічна формула яких складається з одного атома металу та однієї або кількох гідроксильних груп. Число одновалентних гідроксильних груп у формулі основи дорівнює валентності металу, тому в загальному вигляді основи мають формулу Ме(ОН)n. Сучасна назва основ складається з назви металу з додаванням до неї слова «гідроксид». Якщо метал проявляє змінну валентність, то після назви металу в дужках зазначається його валентність. За звичайних умов основи перебувають у твердому стані, частина з них добре розчиняється у воді. Розчинені у воді основи — луги.
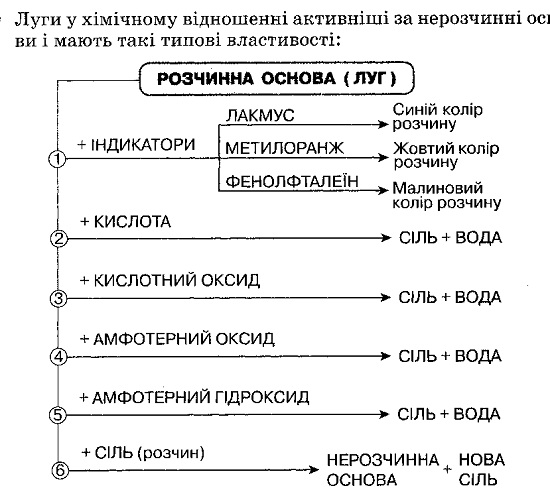
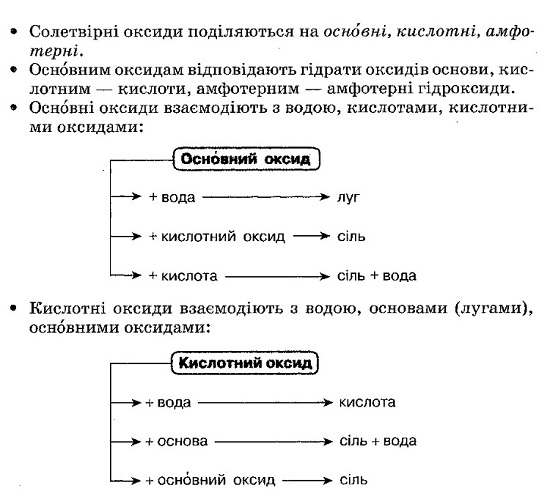
Оксиди здатні до взаємодії з іншими речовинами. Оксидам відповідають гідрати оксидів — кислоти й основи. Валентність кислототвірного елемента в кислоті дорівнює його валентності у відповідному оксиді. Валентність металу в основі збігається з його валентністю у відповідному оксиді. Наявність лугу в розчині (лужного середовища) виявляють за допомогою індикаторів: лакмусу, фенолфталеїну, метилового оранжевого.
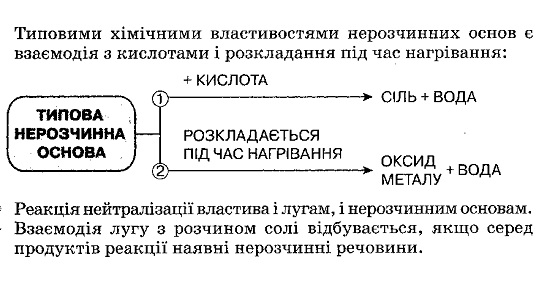
За характерними хімічними властивостями основи поділяють на типові та амфотерні гідроксиди. Амфотерні гідроксиди, на відміну від типових, взаємодіють не лише з кислотами, а й з лугами, утворюючи солі.
У формулах солей, утворених взаємодією амфотерного гідроксиду з кислотою, металічним елементом утвореної солі є метал, що входив до складу основи (2пS04, 2пС12 тощо).
У формулах солей, утворених взаємодією амфотерного гідроксиду з лугом, металічний елемент амфотерного гідроксиду входить до складу кислотного залишку (Nа2[2п(ОН)4], К2[2п(ОН)4] та деякі інші).
Солі сульфатної кислоти можна виявити в розчині за допомогою розчинів солей Барію.
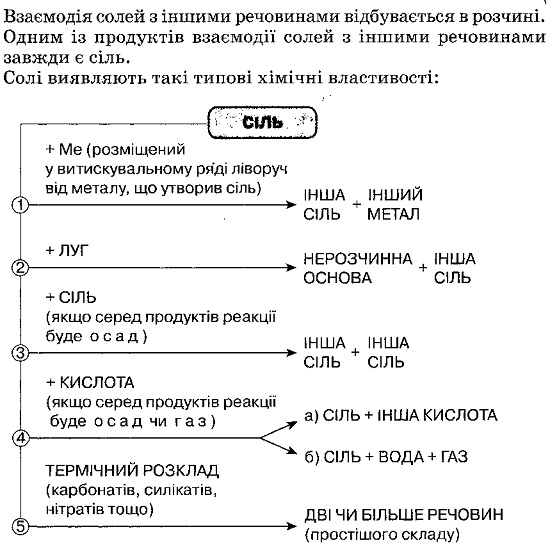
Солі належать до поширених у природі складних неорганічних речовин, серед яких найбільше хлоридів, силікатів, карбонатів, сульфатів, ортофосфатів. Частина солей використовується відразу після видобутку, а частина піддається хімічній переробці з методо добування нових речовин. Солі знаходять найрізноманітніше застосування у хімічній промисловості та багатьох інших галузях народного господарства, а також у побуті. Україна багата покладами солей. Хімічні реакції супроводжуються утворенням різних сполук, що дає змогу з відповідних реагентів добути потрібні речовини. До загальних способів добування оксидів належать: окиснення простих і складних речовин, розкладання нерозчинних гідроксидів під час нагрівання та деякі інші. До загальних способів добування розчинних основ (лугів) належать: взаємодія відповідних металів з водою, взаємодія відповідних оксидів з водою та електроліз (розклад) розчинів солей безоксигенових кислот. Нерозчинні основи добувають взаємодією розчину їх солі з розчином лугу. Солі добувають взаємодією речовин, що містять металічний елемент простої речовини металу, складних речовин, оксиду металу, гідроксиду металу, солі з речовинами, до складу яких входить кислотний залишок (кислота, сіль). Також взаємодією кислотних оксидів з основними оксидами чи лугами.
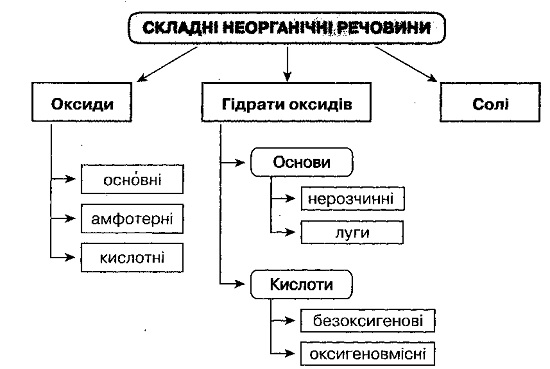
Генетичний звязок неорганічних речовин.

 Virtual chemistry laboratory
Virtual chemistry laboratory 











