Тема уроку. Хімічні властивості альдегідів. Реакція окиснення й відновлення. Одержання етаналю. Використання метаналю й етаналю
Цілі уроку: ознайомити учнів з хімічними властивостями альдегідів, пов’язаними з карбонільною групою, способами одержання альдегідів на прикладі оцтового альдегіду; визначити галузі використання альдегідів з огляду на їхні фізичні й хімічні властивості; ознайомити учнів з якісною реакцією на альдегідну функціональну групу; розвивати вміння й навички учнів складати структурні формули й рівняння хімічних реакцій на прикладі хімічних властивостей оцтового альдегіду, його гомологів та ізомерів.
Тип уроку: вивчення нового матеріалу.
Форми роботи: навчальна лекція, фронтальна робота, віртуальний лабораторний експеримент.
II. Актуалізація опорних знань. Мотивація навчальної діяльності
1. Експрес-опитування
1) Виберіть правильну назву альдегіду, структурна формула якого:
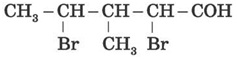
а) 3-метил-2,4-дибромпентаналь;
б) 3-метил-2,4-дибромбутаналь;
в) 2,4-дибром-З-метилпентаналь.
2) До фізичних властивостей метаналю належить:
а) рідина, добре розчинна у воді, з характерним запахом;
б) газ, добре розчинний у воді, з різким запахом, отруйний;
в) тверда речовина, розчинна у воді, без запаху.
3) Функціональна група альдегідів:
а) гідроксильна; б) карбонільна;
в)карбоксильна.
2. Фронтальна робота
Двоє учнів працюють біля дошки.
1) Побудуйте ізомери складу С5Н10О, назвіть їх.
2) Поясніть, чому за кімнатної температури альдегіди є рідинами.
III. Вивчення нового матеріалу
ХІМІЧНІ ВЛАСТИВОСТІ АЛЬДЕГІДІВ
1. Вступне слово вчителя
Альдегіди характеризуються високою реакційною здатністю. Переважна частина їхніх реакцій зумовлена наявністю карбонільної групи. Атом Карбону в карбонільній групі перебуває в стані sp2-гібридизації й утворює три σ-зв’язки (один з них — зв’язок С-О), які розташовані в одній площині під кутом 120° один до одного.
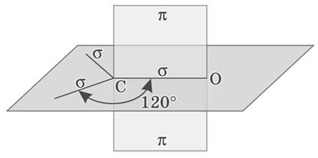
Схема будови карбонільної групи
Подвійний зв’язок карбонільної групи за фізичною природою подібний до подвійного зв’язку між атомами Карбону, тобто це поєднання σ і π-зв’язків, останній з яких утворений р-електронами атомів Карбону й Оксигену. Через більшу електронегативність атома Оксигену порівняно з атомом Карбону зв’язок С = О є дуже поляризованим за рахунок зсуву електронної густини π-зв’язку в бік атома Оксигену, у результаті чого на атомі Оксигену виникає частковий негативний (8-), а на атомі Карбону — частковий позитивний (8+) заряди:
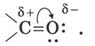
Завдяки поляризації атом Карбону карбонільної групи має електрофільні властивості й здатен реагувати з нуклеофільними реагентами. Найважливішими реакціями альдегідів є реакції нуклеофільного приєднання за подвійним зв’язком карбонільної групи.
Для карбонільних сполук характерними є реакції різних типів:
• приєднання за карбонільною групою;
• полімеризації;
• конденсації;
• відновлення и окиснення.
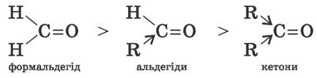
Більшість реакцій альдегідів і кетонів відбувається за механізмом нуклеофільного приєднання (AN) за зв’язком С = O.
Реакційна здатність у таких реакціях зменшується від альдегідів до кетонів:
1) Повне окиснення (горіння):
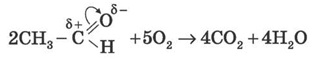
2) Приєднання водню до альдегідів (гідрування) здійснюється в присутності каталізаторів (Ni, Co, Pd та ін.) і приводить до утворення первинних спиртів:
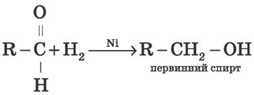
*Часто як відновлювальний агент застосовують літій алюмогідрид LiAlH4 і натрій борогідрид NaBH4.
Крім реакцій приєднання за карбонільною групою, для альдегідів характерними є також реакції окиснення.
3) Окиснення. Альдегіди легко окиснюються, утворюючи відповідні карбонові кислоти:
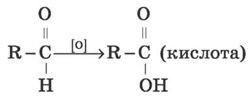
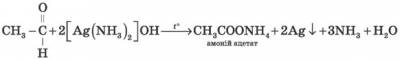
а) Амоніаковий розчин арґентум(І) оксиду [Ag(NH3)2]OH у процесі нагрівання з альдегідами окиснює альдегід до кислоти (у формі її амонієвої солі) з утворенням вільного металевого срібла. Відновлене срібло лягає тонким шаром на стінки хімічної посудини, у якій протікає реакція, і виходить срібне дзеркало. Така взаємодія отримала назву реакції «срібного дзеркала» і є якісною на альдегіди.
Лабораторний дослід 2. Окиснення метаналю (етаналю) арґентум(І) оксидом
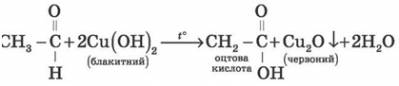
б) Ще однією характерною реакцією є окиснення альдегідів купрум(ІІ) гідроксидом.
Лабораторний дослід 3. Окиснення метаналю (етаналю) купрум(ІІ) гідроксидом
У результаті нагрівання блакитного купрум(ІІ) гідроксиду з розчином оцтового альдегіду випадає червоний осад купрум(ІІ) оксиду. При цьому оцтовий альдегід окиснюється до оцтової кислоти, а Купрум зі ступенем окиснення +2 відновлюється до ступеня окиснення +1. Мурашиний альдегід (формальдегід) посідає особливе місце в ряду альдегідів. Через відсутність у мурашиного альдегіду радикала йому властиві деякі специфічні властивості. Окиснення формальдегіду, наприклад, здійснюється до карбон діоксиду СO2.
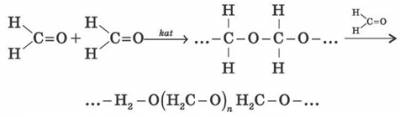
4) Формальдегід легко полімеризується з утворенням циклічних і лінійних полімерів. Так, у кислому середовищі він утворює циклічний тример — триоксиметилен.
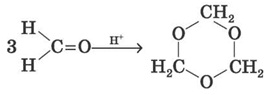 (триоксиметилен)
(триоксиметилен)
Сухий газоподібний формальдегід у присутності каталізаторів утворює високомолекулярний поліформальдегід. Полімеризація формальдегіду нагадує полімеризацію алкенів.
У водних розчинах формальдегід утворює полімер, який називається параформом.
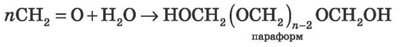
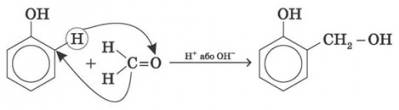
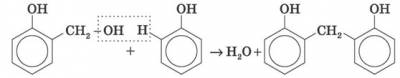
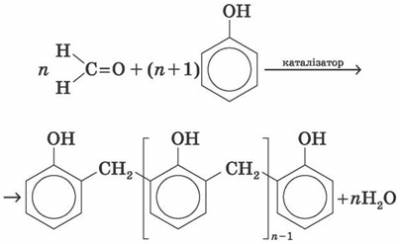
5) Особливе практичне значення має реакція поліконденсації формальдегіду з фенолом з утворенням феноло-формальдегідних смол. У разі дії лужних або кислих каталізаторів на суміш фенолу й формальдегіду конденсація відбувається в орто- й пара- положеннях.
іт. д.
Сумарно реакцію поліконденсації фенолу з формальдегідом можна зобразити так:
Феноло-формальдегідні смоли — первістки промислових синтетичних смол, їх виробництво за назвою «бакеліт» уперше було розпочато 1909 р. Феноло-формальдегідні смоли використовуються у виробництві різних пластмас. У поєднанні з різними наповнювачами такі пластмаси називаються фенопластами. Крім того, феноло-формальдегідні смоли застосовуються для виготовлення різних клеїв і лаків, термоізоляційних матеріалів, деревних пластиків, ливарних форм тощо.
2. Застосування альдегідів
1) Застосування формальдегіду:
• для одержання карбамідних смол у процесі взаємодії із сечовиною, на основі яких виробляються пластмаси, необхідні для потреб електротехніки;
• розчини формальдегіду (формалін) використовуються в шкіряній промисловості для дублення шкір, для дезінфекції зерно- й овочесховищ, теплиць, парників, для протруювання насіння перед посівом, для зберігання анатомічних препаратів, а також у виробництві деяких лікарських препаратів.
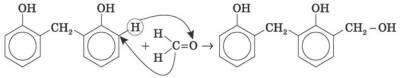
2) Оцтовий альдегід є вихідною сировиною для одержання в промисловому масштабі оцтової кислоти, оцтового ангідриду, етилового спирту, етилацетату та інших цінних продуктів, а в результаті конденсації з амінами й фенолами — різних синтетичних смол.
3) Метаналь (мурашиний альдегід) СН2 = О:
• виробництво феноло-формальдегідних смол;
• виробництво сечовино-формальдегідних (карбамідних) смол;
• поліоксиметиленові полімери;
• синтез лікарських засобів (уротропін);
• дезінфікуючий засіб;
• консервант біологічних препаратів (завдяки здатності згортати білок).
4) Етаналь (оцтовий альдегід, ацетальдегід) СН3СН = О:
• виробництво оцтової кислоти;
• органічнии синтез.
5) Ацетон СН3 - СО - СН3:
• розчинник лаків, фарб, ацетатів целюлози;
• сировина для синтезу різних органічних речовин.
IV. Первинне застосування одержаних знань
1. Які з наведених нижче структур належать до альдегідів і кетонів?
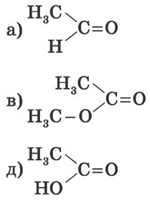
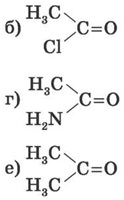
2. Визначте речовини А і Б у схемі перетворень:
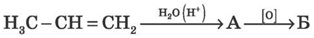
3. З 92 г етанолу одержали 70 г етаналю. Обчисліть масову частку виходу продукту у відсотках від теоретично можливого.
Оцінювання роботи учнів на уроці.
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.

 Virtual chemistry laboratory
Virtual chemistry laboratory